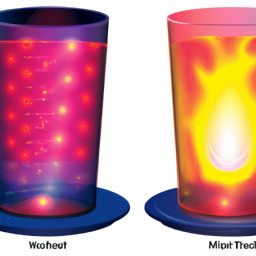
 Wenn wir über chemische Reaktionen sprechen, hat jede Reaktion ihre eigene Art, Energie aufzunehmen oder abzugeben. Dabei ist es wichtig, die Unterschiede zwischen endothermen und exothermen Reaktionen zu verstehen. Chemische Prozesse, bei denen Energie in Form von Wärme entweder aufgenommen oder abgegeben wird, werden je nach Art der Energieübertragung als endotherm oder exotherm bezeichnet.
Wenn wir über chemische Reaktionen sprechen, hat jede Reaktion ihre eigene Art, Energie aufzunehmen oder abzugeben. Dabei ist es wichtig, die Unterschiede zwischen endothermen und exothermen Reaktionen zu verstehen. Chemische Prozesse, bei denen Energie in Form von Wärme entweder aufgenommen oder abgegeben wird, werden je nach Art der Energieübertragung als endotherm oder exotherm bezeichnet.
Endotherme Reaktionen
Endotherme Reaktionen sind chemische Reaktionen, bei denen das System, in dem die Reaktion stattfindet, Energie aus der Umgebung absorbiert. Diese Energie wird benötigt, um die chemischen Bindungen zwischen den Reaktanten zu brechen, und sie wird normalerweise in Form von Wärme aufgenommen. Während einer endothermen Reaktion fühlt sich die Umgebung daher kälter an, da Wärme aus der Umgebung aufgenommen wird. Ein gutes Beispiel für eine endotherme Reaktion ist die Auflösung von Ammoniumnitrat in Wasser, bei der das Gefäß spürbar kälter wird, wenn das Ammoniumnitrat aufgelöst wird.
Exotherme Reaktionen
Im Gegensatz zu endothermen Reaktionen sind exotherme Reaktionen chemische Reaktionen, bei denen Energie in Form von Wärme an die Umgebung abgegeben wird. Dies geschieht aufgrund einer Freisetzung von Energie, die während des Prozesses der Bildung neuer chemischer Bindungen auftritt. Die Umgebung fühlt sich daher während einer exothermen Reaktion wärmer an, da Wärmeenergie an die Umgebung abgegeben wird. Ein alltägliches Beispiel für eine exotherme Reaktion ist die Verbrennung von Holz in einem Kamin, bei der Wärme in Form von Feuer und verbrennenden Gasen abgegeben wird.
Wichtige Aspekte bei endothermen und exothermen Reaktionen
Eines der wichtigsten Kriterien zur Unterscheidung zwischen endothermen und exothermen Reaktionen ist die Änderung der Enthalpie, die als innere Energie eines Systems definiert ist. Bei endothermen Reaktionen nimmt die Enthalpie des Systems zu, während sie bei exothermen Reaktionen abnimmt. Diese Änderung der Enthalpie wird häufig als ΔH bezeichnet, wobei ein positives ΔH auf eine endotherme Reaktion und ein negatives ΔH auf eine exotherme Reaktion hinweist.
Ein weiterer wichtiger Aspekt ist die Geschwindigkeit der Reaktionen. Exotherme Reaktionen verlaufen in der Regel schneller als endotherme Reaktionen, da sie Energie abgeben und somit die Aktivierungsenergie leichter erreichen können. Endotherme Reaktionen hingegen benötigen zusätzliche Energie, um die Aktivierungsenergie zu überwinden, und laufen daher langsamer ab.
Die Unterschiede in einer Tabelle zusammengefasst
| Endotherme Reaktionen | Exotherme Reaktionen |
|---|---|
| Energie wird aus der Umgebung aufgenommen | Energie wird an die Umgebung abgegeben |
| Die Umgebung wird kälter | Die Umgebung wird wärmer |
| Positive Änderung der Enthalpie (ΔH) | Negative Änderung der Enthalpie (ΔH) |
| Reaktionsgeschwindigkeit ist generell langsamer | Reaktionsgeschwindigkeit ist generell schneller |