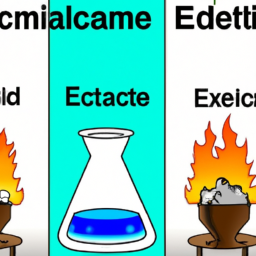
 In der Chemie spielen thermische Prozesse eine wichtige Rolle, insbesondere bei chemischen Reaktionen. Ein grundlegendes Verständnis der Unterschiede zwischen endothermen und exothermen Reaktionen ist entscheidend, um die Energieumwandlung, die bei vielen chemischen Prozessen auftritt, besser zu begreifen. In diesem Artikel werden wir die Unterschiede zwischen endothermen und exothermen Reaktionen erläutern und ihre Merkmale und Beispiele vorstellen.
In der Chemie spielen thermische Prozesse eine wichtige Rolle, insbesondere bei chemischen Reaktionen. Ein grundlegendes Verständnis der Unterschiede zwischen endothermen und exothermen Reaktionen ist entscheidend, um die Energieumwandlung, die bei vielen chemischen Prozessen auftritt, besser zu begreifen. In diesem Artikel werden wir die Unterschiede zwischen endothermen und exothermen Reaktionen erläutern und ihre Merkmale und Beispiele vorstellen.
Endotherme Reaktionen
Endotherme Reaktionen sind solche Reaktionen, bei denen Energie in der Form von Wärme von der Umgebung aufgenommen wird. Solche Reaktionen haben eine positive Reaktionswärme bzw. Enthalpie, was bedeutet, dass die Energie der Produkte größer ist als die der Reaktanten. Da endotherme Reaktionen Wärme von der Umgebung absorbieren, führt dies zu einer Abkühlung der Umgebung. Ein Beispiel für eine endotherme Reaktion ist das Schmelzen von Eis oder die Photosynthese, bei der Pflanzen Lichtenergie aufnehmen, um sie in chemische Energie umzuwandeln.
Exotherme Reaktionen
Im Gegensatz zu endothermen Reaktionen geben exotherme Reaktionen Wärmeenergie an die Umgebung ab. Diese Reaktionen haben eine negative Reaktionswärme, da die Energie der Produkte niedriger ist als die der Reaktanten. Exotherme Reaktionen sind häufig von Natur aus spontan, da sie dazu neigen, die energetische Stabilität zu erhöhen. Darüber hinaus erwärmen sie die Umgebung, da sie Energie in Form von Wärme abgeben. Beispiele für exotherme Reaktionen sind die Verbrennung von Kohlenwasserstoffen, wie sie in Fahrzeugmotoren oder bei der Energiegewinnung aus fossilen Brennstoffen stattfindet, und die Reaktion von Natrium mit Wasser.
Vergleich der Eigenschaften von endothermen und exothermen Reaktionen
Obwohl sowohl endotherme als auch exotherme Reaktionen Energiewechsel zwischen Reaktanten und Produkten beinhalten, gibt es einige grundlegende Unterschiede, die sie voneinander trennen. Abgesehen von den bereits erwähnten Unterschieden in Bezug auf positive oder negative Reaktionswärme und ihre Auswirkungen auf die Umgebung, unterscheiden sich endotherme und exotherme Reaktionen auch in ihrer Spontaneität und den Bedingungen, die für ihre Durchführung erforderlich sind. Endotherme Reaktionen erfordern normalerweise eine kontinuierliche Energiezufuhr, um fortzufahren, während exotherme Reaktionen oft spontan ablaufen, sobald die erforderlichen Aktivierungsenergien erreicht sind.
Tabelle zum Vergleich von endothermen und exothermen Reaktionen
| Endotherme Reaktionen | Exotherme Reaktionen | |
|---|---|---|
| Reaktionswärme | Positiv | Negativ |
| Auswirkung auf die Umgebung | Absorbiert Wärme (Abkühlung der Umgebung) | Gibt Wärme ab (Erwärmung der Umgebung) |
| Spontaneität | Oft nicht spontan | Häufig spontan |
| Energiebedarf | Kontinuierliche Energiezufuhr erforderlich | Aktivierungsenergie erforderlich, dann oft selbsttragend |
Zusammenfassend lassen sich endotherme und exotherme Reaktionen anhand ihrer Energiewechsel, ihrer Auswirkungen auf die Umgebung, ihrer Spontaneität und der für ihre Durchführung erforderlichen Bedingungen unterscheiden. Das Verständnis der Unterschiede zwischen diesen Reaktionstypen ist entscheidend für das Studium energieumwandelnder Prozesse in der Chemie und in verwandten Disziplinen.